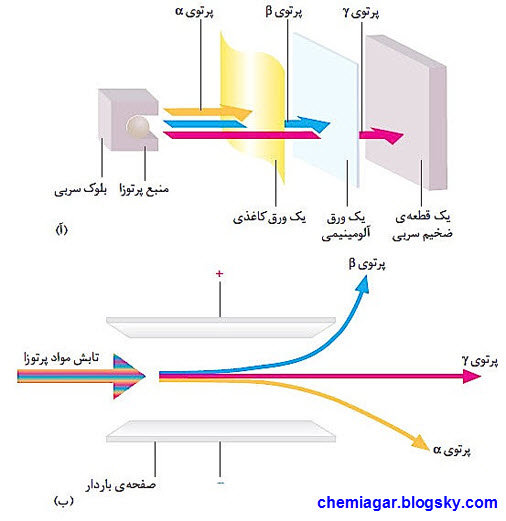
کشف نوترون
رادرفورد وجود ذره دیگری در
اتم را که خنثی بود حدس زد.
او
گفت که در اتم هیدروژن یک پروتون و در اتم هلیم دو پروتون وجود دارد.
پس باید جرم هلیم دو برابر جرم هیدروژن باشد.اما این طور نبود (بلکه جرم هلیم چهار
برابر جرم هیدروژن می باشد.) او گفت پس باید ذره دیگری در کار باشد. که جرم آن حدوداً
نزدیک به جرم پروتون است و اما در بار اتم نقشی ندارد یعنی خنثی است
اما چادویک
با آزمایش بمباران Be برلیم توسطه اشعه آلفا به
وجود نوترون پی برد و آن را کشف کرد.
کشف
عدد اتمی (Z)
موزلی با مطالعه اشعه ایکس تولید شده (در لامپ اشعه x) و بررسی فرکانس اشعه ایکس تولید شده، متوجه شد فرکانس اشعه Xبا افزایش جرم اتم افزایش می یابد. سپس مقدار کل بار مثبت درون هسته هر اتم را حساب کرد. از تقسیم مقدار کل بار مثبت هسته بر بار الکتریکی یک پروتون تعداد پروتون های درون هسته هر اتم را پیدا کرد
از آن جایی که اتم ذره ای خنثی است. بنابراین تعداد الکترون ها نیز از روی عدد اتمی (Z) مشخص می شود. از روی عدد اتمی می توان نوع عنصر را معین کرد.
در واقع ماهیت هر عنصر به عدد اتمی (Z) آن بستگی دارد.
جرم یک اتم به تعداد
پروتون و نوترون درون هسته آن بستگی دارد. ( از جرم الکترون به علت ناچیزی صرف نظر می کنیم )
از این رو به مجموع تعداد
پروتون و نوترون یک اتم عدد جرمی می گویند و به A نمایش می دهند.
جرم اتم ها را با دقت بسیار زیادی با دستگاهی بنام طیف سنج جرمی اندازه گیری می کنند ، به کمک این دستگاه معلوم شده که جرم همه اتم های یک عنصر یکسان نیست.
از آن جائیکه تعداد
پروتون ها در همه اتم های یک عنصر یکسان است پس تفاوت در تعداد
نوترون است ( و این یعنی مفهوم ایزوتوپی است )
در واقع ایزوتوپ ها اتم
های یک عنصر هستند که عدد اتمی (Z) یکسان و عدد جرمی
(A) متفاوت دارند.
نکته:هیدروژن دارای سه
ایزوتوپ است. هیدروژن تنها عنصری است که نوترون ندارد
نکته: خواص شیمیایی ایزوتوپ های یک عنصر یکسان است زیرا خواص شیمیایی یک عنصر به الکترون ها و پروتون های آن بستگی دارد. ولی خواص فیزیکی ایزوتوپ ها با هم متفاوت است ( یعنی از نظر جرم سنگینی ـ چگالی و نقطه جوش و ... )
نکته: ایزوتوپ ها به دلیل
داشتن عدد اتمی یکسان مکان یکسانی در جدول تناوبی دارند. ایزوتوپ یعنی (هم
مکان) به همین دلیل جرم میانگین عنصرها را حساب می کنند و در جدول تناوبی عناصر
قرار می دهند.
جرم یک اتم
اتم ها ذرات بی نهایت
ریزی هستند و جرم یک اتم آنقدر کم و ناچیز است که نمی توان با دقیق ترین
ترازوها نیز جرم آن را بدست آورد.
اما بطور تجربی می توان جرم یک اتم را نسبت به اتم دیگر بدست آورد.
در ابتدا هیدروژن و اکسیژن اساس سنجش جرم اتم ها بوده اند. اما اکنون براساس توافق بین المللی جرم یک اتم کربن 12 به عنوان واحد جرم اتمی پذیرفته شده و به جرم یک دوازدهم آن 1amu می گویند.
دانشمندان جرم اتم کربن را برابر 12.000 amu قرار دادند
= 1 amuجرم یک نوترون یا جرم یک پروتون
= 1/ 2000 amu جرم یک
الکترون
با توجه به وجود ایزوتوپ ها و تفاوت در فراوانی آنها برای بدست آوردن جرم نمونه های طبیعی از اتم های عنصرهای
مختلف جرم اتمی میانگین به کار می رود.
تولید رنگهای متفاوت در هنگام آتش بازی:
در آزمایش شعله هنگامیکه
مثلاً ترکیب مس دار داشته باشیم، رنگ آبی شعله به سبزی
می گراید.
و اگر در لوله پرتوی کاتدی گاز هیدروژن باشد به رنگ صورتی در می آید.
این سؤال در ذهن به وجود
می آید که این رنگها چگونه تولید می شود و مربوط به چیست؟
اگر رنگ تولید شده از ملتهب شدن گاز هیدروژن در لوله پرتوی کاتدی به وسیله منشور تجزیه کنیم و آن را بر روی آشکارساز (فیلم عکاسی) ظاهر کنیم، می بینیم که یک الگو ظاهر می شود. این الگوی انرژی منحصر به فرد را طیف می گویند.
به نور نشر شده از اتم های ملتهب که مورد تجزیه قرار می گیرند (به وسیله منشور) طیف نشری- خطی می گویند.
طیف:
1ـ پیوسته: مثل طیف نوری سفید که از
منشور گذرانده شود، که تمام طول موج های نور مریی را دارد، به
طوریکه نوار
رنگی با کناره ی نوار مجاور در هم می
آمیزد
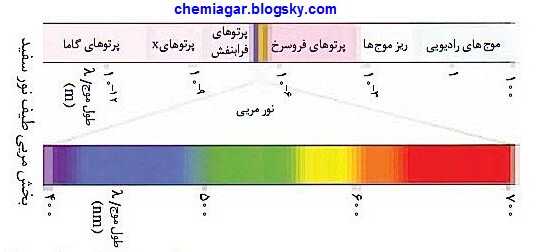
2ـ ناپیوسته (گسسته): طیف عناصر به حالت ملتهب
که مجموعه از بعضی طول موج ها را دارد
طیف:
-1 جذبی: خطهای تاریک در زمینه ی روشن معرف
طول موجهای جذب شده هستند.
-2 نشری: (گسیلی): خطهای روشن در زمینه ی
تاریک معرف طول موج های گسیلی هستند.
با گذراندن طیف جذبی و
نشری یک عنصر بر روی هم یک طیف پیوسته بوجود می آید.
در طیف نشری و طیف جذبی
هر عنصر فقط طول موجهای معینی وجود دارد
خط های معین و مشخص و ثابت چه در زمینه ی روشن و چه در زمینه ی تاریک اتم هر عنصر همان طول موج هایی است که از نور سفید (طیف پیوسته) جذب می کند، که اگر به اندازه کافی گرم شود همان طول موج ها را تابش و نشر می کند.
هر خط در طیف؛ مربوط به
یک طول موج با انرژی مشخص و ثابت است.
کشف
رابطه میان طیف (الگوی ثابت انرژی) با ساختار اتم:
وجود یک ارتباط معنی دار
میان الگوی ثابت و مشخص و معین انرژی (یعنی همان طیف نشری خطی هیدروژن) با
ساختار اتم، ذهن دانشمندان را به خود مشغول کرد. مدل اتمی رادرفورد برای توجیه این
طیف نارسا بود.زیرا طبق مدل اتمی رادرفورد الکترون ها در طراف هسته قرار گرفته اند.
در مدل اتمی رادرفورد در
رابطه چگونگی توزیع الکترون در اطراف هسته توجیه درستی نبود ، پس، از
توجیه طیف خطی و گسسته اتم های عناصر عاجز خواهد بود. طبق این مدل
الکترون می تواند هر مقدار
انرژی را داشته باشد.
(طبق این مدل، اگر الکترون ثابت و ساکن فرض شود، به علت جاذبه هسته، روی هسته
سقوط خواهد کرد.) و یا اگر حرکت داشته باشد، یک حرکت مارپیچی که انرژی الکترون
رفته رفته کم شود و با تابش طیف پیوسته، نهایتاً روی هسته سقوط خواهد کرد
![]()
مدل اتمی بور
بور با ارائه مدل تازه ای
برای اتم هیدروژن، این نارسائی را تا حدی برطرف کرد:
- 1 الکترون در اتم هیدروژن
در مسیری دایره ای شکل به دور هسته گردش می کند.
- 2 انرژی این الکترون با فاصله آن از هسته رابطه ای مستقیم دارد
- 3 این الکترون فقط می تواند در فاصله های معین و ثابتی پیرامون هسته گردش کند.
در واقع الکترون تنها مجاز است که مقادیر معینی انرژی را بپذیرد. به هر یک از این مسیرهای دایره ای (مدارها) مجاز، تراز انرژی می گویند. تعداد این ترازهای انرژی در اتم اندک است.
- 4 این الکترون معمولاً در پایین ترین تراز انرژی ممکن (نزدیکترین مدار به هسته) قرار دارد. به این تراز انرژی، حالت پایه گویند.
- 5 با دادن مقدار معینی انرژی به این الکترون، می توان آن را قادر ساخت که از حالت پایه (ترازی با انرژی کمتر) به حالت برانگیخته (ترازی با انرژی بالاتر) انتقال پیدا کند.
- 6 الکترون در حالت برانگیخته، ناپایدار است، از این رو همان مقدار انرژی را که پیش از این گرفته بود، از دست می دهد و به حالت پایه باز می گردد.
از آنجایی که انرژی اضافه
الکترون در حالت برانگیختگی باعث ناپایداری اتم می شود، اتم
تمایل دارد با از دست
دادن انرژی به حالت پایه اتم که حالت پایدار است، برسد.
این انرژی را در ناحیه مرئی به صورت نشر نور از دست می دهد.
مقدار انرژی لازم برای
جهش الکترون بین دو سطح را کوانتوم گویند:
انرژی یک کمیت کوانتومی
است. (معنی کوانتومی = پیمانه ای ـ بسته ای ـ کمیت ناپیوسته و گسسته که
دارای مقدار معینی انرژی می باشد)
بور با کوانتیده در نظر
گرفتن ترازهای انرژی یا به عبارت دیگر، کوانتومی در نظر گرفتنمبادله انرژی
هنگام جابجائی میان ترازهای یاد شده، توانست با موفقیت طیف نشری خطی
هیدروژن را توجیه کند.
طبق نظریه بور، الکترون
فقط وقتی می تواند تابش کند و نور منتشر کند که ازمدار بالاتر به مدار
پائین تر بیفتد و هنگامی که الکترون در مدار خود هست، انرژی معینی دارد و پایدار است.
![]()
انرژی یک الکترون نیز
کوانتومی است. یعنی مقدار معینی انرژی (نه هر مقدار) و چون انرژی لازم برای جهش
الکترون بین دو تراز انرژی اتم نیز کوانتومی است، هنگامی که الکترون به مدار خود برمی
گردد، انرژی اضافی خود را که کسب کرده بود، دوباره از دست می دهد و نور نشر می کند،
یعنی دارای طول موج معین نیز خواهد بود.
اساساً در جهان دو نوع رفتار قابل مشاهده است :
رفتار ذره ای ـ رفتار موجی
نور هم خاصیت ذره ای و
هم
خاصیت موجی دارد. رفتار ذره ای مانند هنگامیکه با
برخورد
فوتون به سطح فلز سزیم (در چشم الکترونیک) جریان الکتریسیته برقرار شود.
( الکترون ها از سطح فلز سزیم جدا می شود که این پدیده فتوالکتریک نام دارد )
نکته: نور از ذرات ریز
به
نام فوتون درست شده است.
نکته: فلز سزیم عنصر
گروه
اول جدول تناوبی که دارای انرژی یونش بسیار پایین است.
الکترون ها نیز دارای
دو
رفتار ذره ای و موجی هستند.
در اشعه کاتدی خاصیت
ذره
ای الکترون را و در میکروسکوپ الکترونی رفتار موجی را
داریم.
ذرات بسیار ریز (نظیر
اتم
و مولکول و ...) که با نور مرئی (به علت بلندی طول موج)
قابل دیدن
نیست با میکروسکوپ الکترونی که با الکترون با طول موج کوتاه کار می کند قابل دیدن
می شود.
الکترون علاوه بر خصلت
ذره ای، خصلت موجی، نیز دارد این خصلت دو گانه باعث
می شود که هرگز نتوان چگونگی جابه جا شدن الکترون از نقطه ای به نقطه ای دیگر
را معین کرد و نیز نمی توان موقعیت الکترون در اتم دو هر لحظه از زمان مشخص نمود:
در مدل کوانتومی (نظریه شرودینگر) که بر پایه خواص موجی الکترون ها، استوار است به جای صحبت از مکان دقیق الکترون، احتمال حضور آن در فضای معینی در اطراف هسته را مورد توجه قرار می دهیم. چنین فضایی را اوربیتال می نامیم.
اوربیتال : فضایی در
اطراف هسته است که احتمال یافتن الکترون در آن بیش از 90%
باشد. ( البته مانند مدل
بور انرژی الکترون کوانتیده است )
1ـ احتمال حضور
الکترون در
جاهای گوناگون در اطراف هسته به وسیله نقطه هایی نشان
داده می شود. تراکم
این نقطه ها در اطراف هسته به صورت ابری در می آید که به آن
ابر الکترونی می گوییم
هر جا که تراکم ابر الکترونی یا نقطه ها بیشتر باشد، احتمال حضور
الکترون
در آن جا نیز بیشتر است.
2ـ اوربیتال یک فضای
احتمالیست که می تواند شکل های مختلفی داشته باشد. اوربیتال ها را
با حروف مشخصی
نامگذاری می کنیم. اوربیتال s و p و d و f
اوربیتال S کروی و P به
صورت دمبل می
باشد.
برای مشخص کردن جایگاه الکترون از اعداد کوانتومی ( ms ml l n ) کمک می گیریم
(پس هر الکترون در هر اتمی دارای آدرس مخصوص است.)
هیچ دو الکترون در یک اتم نمی تواند چهار عدد کوانتومی یکسان داشته باشند.
ممکن است در سه عدد کوانتومی ml l n یکی باشند اما در ms باید متفاوت باشند
روش
پر کردن اوربیتال ها : روش آفبا
-1الکترون
ها به ترتیب در
اوربیتال هایی جای می گیرند که کمترین سطح انرژی را داشته
باشند.
-2در هر
اوربیتال حداکثر دو
الکترون با اسپین مخالف می تواند قرار
بگیرد.
اصل
طرد پاولی : هیچ دو الکترونی در اتم نمی تواند چهار عدد کوانتومی یکسان داشته باشد
-3 اصل
هوند در یک زیر لایه مثلاً 2p یا 3d ابتدا به
هر اوربیتال یک الکترون تعلق می گیرد. ( با اسپین مثبت ) سپس جفت شدن آغاز می
شود.
![]()
آرایش الکترونی
اتم:
هیدروژن به خاطر داشتن تنها یک الکترون ، سطح انرژی زیر لایه ها در هر لایه ی الکترونی اصلی فقط به n عدد کوانتومی اصلی وابسته است.
در مورد پر شدن زیر لایه ها مربوط به تراز انرژی اصلی در اتم
در مورد روش افبا به طور خلاصه می توان گفت :
np (n-1)d (n -2)f ns
مقایسه دو اوربیتال از نظر سطح انرژی
اوربیتالی که مجموع اعداد کوانتومی اصلی و اوربیتالی آن پایین تر است سطح انرژی پایین تری قرار دارد و به هسته نزدیک تر است.
2s < 2p
3=2+1 2+0=2
اگر مجموع اعداد کوانتومی اصلی (n و l)
اربیتالی برابر شود در این صورت آن که عدد
کوانتومی اصلی پایین تر دارد (n کوچکتر) در سطح انرژی پایین تر قرار دارد.
4p> 3d
5=3+2 = 5=4+1
در اوربیتال حداکثر دو الکترون با اسپین متفاوت قرار دارند.
چرا در هر اوربیتال حداکثر دو الکترون کنار هم قرار می گیرند ؟
طبق مشاهدات تجربی برای توجیه برخی خواص فیزیکی اتم ها ( مثلاً نظیر خواص مغناطیسی آن ها و یا مغناطیسی نبودن آنها ) نسبت دادن دو الکترون در یک اوربیتال قابل توضیح است.
پس اتم هایی که دارای الکترونهای منفرد باشند از خود خواص مغناطیسی نشان می دهند و اتم هایی که تمام الکترون های آنها زوج شده باشد خواص غیر مغناطیسی نشان میدهند. الکترون ها دارای دونوع حرکت هستند.
1 - حرکت اوربیتالی ( حرکت الکترون به دور هسته ی اتم )
2 - حرکت اسپینی ( حرکت الکترون به دور خود )
چون الکترون ذره ی باردار است در حین حرکت در اطراف خود میدان مغناطیسی ایجاد می کند و تبدیل به یک آهن ربای کوچک می شود
( حال اگر قرار باشد دو الکترون در کنار هم در یک اربیتال قرار بگیرند باید جهت حرکت انها مخالف هم باشند تا میدان مغناطیسی ایجاد شده بر نیروی دافعه دو بار الکتریکی منفی هم نام را از بین ببرد ) پس در یک اربیتال دو الکترون دو جهت ساعتگرد و پاد ساعتگرد را به خود می گیرند.
آدرس دهی یک الکترون :
با داشتن اعداد کوانتومی جای الکترون در اطراف هسته راپیدا می کنیم .
مثال : این اربیتال دارای چه اعداد کوانتومی است؟ 3pz
n=3 l=1 m l =-1 ms =+1/2 , -1/2
![]()
حال باید گفت که الکترون ها در زیر لایه ها مثلاً در زیر لایه P چگونه قرار می گیرند (در اربیتال های px py pz )
طبق قاعده موند اربیتال های هم تراز و هم انرژی یک لایه در پایدارترین وضعیت ، الکترون هایش به صورت دارای اسپین مثبت در هر اربیتال یک الکترون قرار می گیرد و سپس در صورت لزوم پس از اینکه هر اربیتال یک الکترون در آن قرار گرفت، جفت شدن الکترون ها صورت می گیرد.
انرژی یونش
آموختید که یونش به معنای خارج کردن یک الکترون از اتم و ایجاد یون است این عمل به انرژی نیاز دارد.
انرژی لازم برای خارج
کردن یک مول الکترون از یک اتم در
حالت گازی و
ایجاد
یک یون یک بار مثبت
در حالت گازی را انرژی نخستین یونش گویند.
به همین ترتیب انرژی دومین یونش، انرژی لازم برای خارج کردن یک مول الکترون از یک مول یون یک بار مثبت در حالت گازی و ایجاد یک مول یون دو بار مثبت در حالت گازی
به همین ترتیب انرژی
های
یونش بعد را تعریف می کنیم
IE1< IE2< IE3<.........
پس با دادن انرژی می توان الکترون های یک اتم را از آن جدا کرد.